栄養
Nutrition
あなたは、あなたが食べてきたそのものです
Nutrition
あなたは、あなたが食べてきたそのものです
2025.10.10
糖尿病は、インスリンの分泌不全や作用不足によって高血糖状態が持続する慢性疾患であり、代謝性疾患として分類されますが、実際には消化管機能との密接な関連が確認されています。
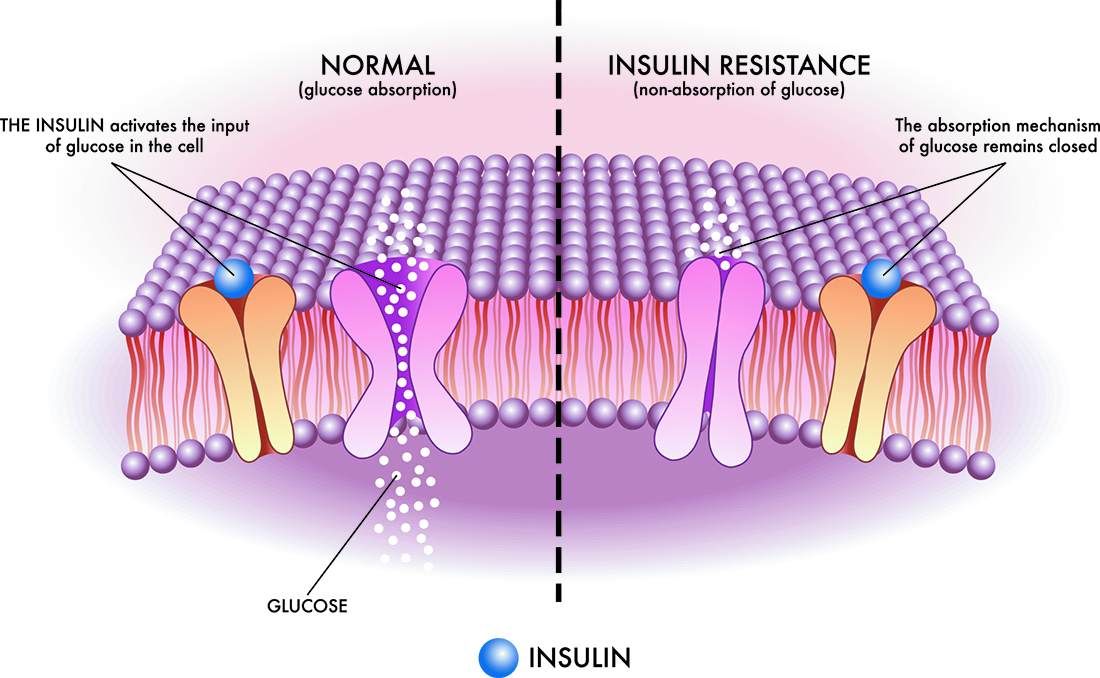
たとえば、2型糖尿病の発症には、食事中の糖質の過剰摂取と、それに伴う腸内細菌叢の変化、腸管バリア機能の低下、慢性炎症などが複雑に関係しています。[1]
小腸の絨毛細胞や腸内ホルモン(インクレチンなど)は、消化吸収とインスリン分泌を連動させる重要な役割を担っており、この機構の破綻がインスリン抵抗性を増強させることが知られています。[2]
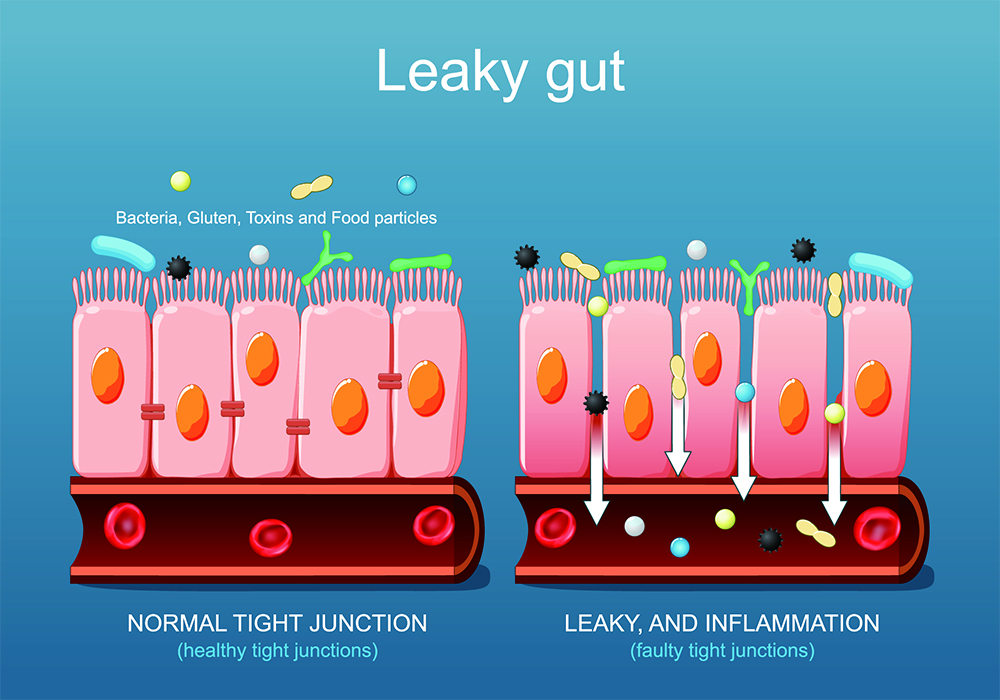
Leaky gut. Close-up of cells of a intestinal epithelium. Difference between Healthy cells, and inflamed intestinal cells. Comparison normal tissue of the gastrointestinal tract, and Intestinal permeability.
現代の高脂肪・高糖質・低食物繊維の食事は、腸内細菌叢の多様性を損ない、腸内細菌叢のバランス(ディスバイオシス)を崩します。
その結果、短鎖脂肪酸の産生が減少し、腸管上皮の炎症や透過性亢進(リーキーガット)が起こりやすくなります。
この腸粘膜バリアの破綻は、リポポリサッカライド(LPS)などの内毒素の血中流入を促し、全身の慢性炎症(メタ炎症)を惹起します。
これは、インスリン抵抗性を高め、糖尿病の発症や悪化に関与すると考えられています。[3・4]
また、特定の腸内細菌(例:Akkermansia muciniphila)の減少は、腸粘膜の健全性とインスリン感受性の低下と相関することが報告されており、腸内環境の修復は糖尿病の予防と治療において重要な戦略とされています。[5]
糖尿病患者では、自律神経障害による胃排出能の低下(胃不全麻痺)や小腸・大腸の蠕動異常が見られることがあります。
これは血糖コントロールを不安定にし、栄養吸収のタイミングにも影響を及ぼします。[6]
さらに、GLP-1(グルカゴン様ペプチド-1)などの腸ホルモンは胃排出を遅らせ、インスリン分泌を促進する作用があるため、これらを模倣したGLP-1受容体作動薬は糖尿病治療薬としても用いられています。

References
 トップへ戻る
トップへ戻る