健康
Health care
いのちまで人まかせにしないために
Health care
いのちまで人まかせにしないために
2025.02.07
あなたが口にする食べ物は、最も安全で効果の高い薬あるいは、最もゆっくり作用する毒のいずれかになる。
アン・ウィグモア(Ann Wigmore・リトアニア系アメリカ人のホリスティックヘルスプラクティショナーで、自然療法医、ローフードの擁護者)
目次
DNAの損傷は老化の典型的な特徴の一つです。

では、DNAはどのようにして傷つくのでしょうか?
DNAは、紫外線、環境有害物質、栄養に欠ける高糖質の加工食品など、さまざまなストレス要因から、日々最大10万回にわたる微細な攻撃を受けています。
このようなダメージの蓄積が老化を加速させます。
しかし、ありがたいことに、わたしたちの身体には、傷ついたDNAを見つけ出して修復するシステムが備わっています。
サーチュインの主な仕事は、DNA修復です。
しかし、たとえ損傷の99%が修復されたとしても、残りの1%は生涯にわたって蓄積され続けます。
細胞は分裂もします。
つまり、各細胞の中にあるDNAの設計図が複製されるのです。
DNAは人の一生のあいだに、細胞分裂によって自らのコピーを1京個〔1000兆の10倍〕作ります。
その際、ときおりコピー機に不具合が生じ、DNAの設計図がその不具合とともに複製されることがあります。
ちょうど、あなたの生命の本に誤字脱字が含まれるようなものです。
では、この状況に対して何ができるのでしょうか?
まず、DNAにダメージを与える損傷を避けることが重要です。
加工食品を排除し、有害物質、放射線、ストレス要因をできる限り減らすことが基本です。
また、「健康長寿プログラム」によって修復システムを活性化させることができます。
そして、最終的にはCRISPR(クリスパー)のようなツールを使って遺伝子を編集することにより、DNAに蓄積された損傷を修復することが可能です。
遺伝子変異が老化の絶対的な原因ではないことを示す証拠として、一卵性双生児の研究が挙げられます。

一卵性双生児は同じ遺伝子配列を持っていますが、それでも同じ病気を発症したり、同じ時期に死を迎えたりするわけではありません。
例えば、スウェーデンで行われた世界最大級の双子研究では、2万966人の双子を36年間にわたって追跡調査しました。
この研究では、一方が心臓病で亡くなった場合、もう一方が同じ病気で亡くなる確率は男性で40%、女性で30%であることがわかりました。
また、動物実験では、妊娠中の母親の食習慣が子供に影響を与え、その影響が子供の一生を通じて続くだけでなく、次の世代にも受け継がれる可能性があることが示されています。
このことから、遺伝的要因が生涯にわたり影響を与えることは間違いありませんが、それが唯一の要因ではないといえます。
では、遺伝以外に老化の原因としてどのような説が考えられているのでしょうか?
以下に、主な説を挙げてみます。
生物や個体ごとに寿命にばらつきはあるものの、生まれてから死ぬまでの時間が遺伝子によってあらかじめプログラムされているという説です。
DNAがさまざまな要因で損傷を受け、その損傷が蓄積することで細胞が機能障害を起こし、老化が進行するとする説です。
加齢に伴い、免疫を担う細胞の機能が低下し、免疫細胞が自分自身の体を攻撃するようになって老化がもたらされるという説です。
DNAが損傷した結果、染色体の異常や突然変異が生じ、それが体のさまざまな機能を阻害して老化を引き起こすとする説です。
これらの中で、特に科学者たちの注目を集めているのが「テロメア説」です。

染色体の末端に付いている小さなキャップのようなテロメアは、加齢とともに短くなり、最終的にはしっかり保護していたDNAの二重らせんがほどけるのを防ぐことができなくなります。
テロメアが長ければ長いほど、DNA複製が健全に行われる年数が長くなります。
一方、テロメアが短ければ短いほど、わたしたちの寿命は短くなります。
染色体は細胞分裂時にコピーされますが、その際、末端部分が完全に複製されないため、遺伝情報が一部失われてしまいます。
そこで、染色体の末端にある「テロメア」が重要な役割を果たしています。
テロメアは、染色体の遺伝情報を守るために自ら短くなることで、細胞の遺伝情報を保護しています。
ただし、細胞が分裂を繰り返し、テロメアが限界まで短くなると、細胞は「これ以上分裂できない」と認識し、細胞老化や細胞死(アポトーシス)を引き起こすことがわかっています。
これは細胞分裂の正常な末路です。
細胞老化とは、細胞が分裂の限界に達した状態を指し、そのような細胞を「老化細胞」と呼びます。
このゾンビ細胞は、老化を促進する炎症性物質を分泌するため、組織や臓器が衰え、個体全体の老化につながります。
そのため、テロメアの長さが老化の進行度や寿命に深く関係していると考えられているわけです。
実際、早老症のひとつであるウェルナー症候群の患者は、同年代の人に比べてテロメアが短いことが知られています。
一方、100歳以上の長寿者やその家族のテロメアは、80代でも60代の平均値に匹敵する長さであるという報告もあります。
また、デンマークで行われた双子研究では、見た目が若い人ほど長寿傾向があり、テロメアが長い、または短いテロメアが少ないことが確認されています。
良いニュースは、わたしたちがテロメアに対して大きな影響を与えられるということです。
生活習慣に関するよくある問題、つまり有害な加工食品、糖分、環境有害物質、座りがちなライフスタイル、心理的ストレスなどは、すべてテロメアを短縮させます。
テロメアの短縮はあらゆる老化の問題と関連しており、白髪になることを始め、心臓病、ガン、免疫機能不全などのリスクを高めます。
科学者たちは、テロメアを「健康長寿の指標」として捉え、テロメアを無駄遣いしない生活習慣を心がけることが重要だと提言しています。

具体的には、以下のような生活習慣がテロメアを守るとされています。
一方で、慢性炎症、糖化、酸化はテロメア短縮を進める要因とされ、これらをできるだけ避けることが大切です。
1985年に発見された「テロメラーゼ」という酵素は、テロメアの短縮を遅らせたり、場合によってはテロメアを伸ばす働きがあります。
この酵素は、生殖細胞や幹細胞(例:造血幹細胞)、さらには無限に増殖するがん細胞で活性化されています。
ただし、通常の細胞ではこの酵素は活性化されません。
一部では、テロメラーゼを活性化させることで老化を防ぐというサプリメントが販売されていますが、科学的に見てこれは簡単な話ではありません。
テロメア短縮の速度は細胞によって異なるため、すべての細胞を一律に修復すると不都合が起きる可能性があります。
テロメラーゼは、がん細胞の増殖にも関与するため、誤った活性化はリスクを伴います。
現時点で、特定の細胞だけでテロメラーゼを活性化させる技術は確立されておらず、実用化はまだ先の話とされています。
テロメアの研究は今後も注目される分野ですが、安全性と実用性を考慮しながら進められる必要があります。
これらの多様な説から、老化は単一の原因ではなく、複数の要因が絡み合った結果であると考えられます。
DNAの仕事は、タンパク質をコードすることだということを覚えていますか?
これらのタンパク質は、体内にあるあらゆるものを制御しています。
臓器、組織、細胞はみなタンパク質からできており、ホルモン、ペプチド、免疫分子、神経伝達物質といった細胞のメッセンジャー分子もタンパク質から作られます。
タンパク質は情報のスーパーハイウェイを形成して、毎秒何兆回にも及ぶ化学シグナル伝達や化学反応を促進しています。
生命の指令を宿すメッセンジャータンパク質の多くは、短命であることが少なくありません。
そして、DNAを傷つける障害と同じものによって損傷を受ける可能性があります。
タンパク質の機能は、アミノ酸の配列だけでなく、立体的な形状や複雑な折り畳みパターンによっても決まります。
タンパク質が傷ついたり、形が崩れたりすれば、そのタンパク質は機能しなくなります。
ありがたいことに、わたしたちの身体には、特徴1で述べたオートファジーというリサイクルシステムが備わっています。
ゴミを飲み込んで細胞を掃除するリソソームという小さなパックマンのようなものを覚えていますか?
これは素晴らしいシステムです。
しかし、わたしたちの多くはそのシステムを妨害するような生活をしています。
わたしたちは常にカロリーを消費していますが、絶え間ない食物(デンプン、糖分、タンパク質)の流れがmTORを活性化し、オートファジーをシャットダウンしてしまいます。
わたしたちは後片付けや修復のために必要なエネルギーの氾濫からの休息を身体に与えていないのです。
そのため、ファスティングの時間を取ること(たとえ夜間の12時間でも)は、わたしたちのライフスタイルによって生じた混乱や傷ついたタンパク質を一掃するチャンスを身体に与えることになるのです。
私たちの体では、本来、古い細胞は新しい細胞と入れ替わることで機能を維持しています。
しかし、加齢とともに細胞の機能が衰え、新陳代謝が低下することで、細胞の数が減少し、生理的な老化が進行します。
ただし、その進行速度は遺伝的要因や生活習慣によって個人差があります。
また、一般的な老化には、生理的老化と病的老化の両方が混在していますが、長寿者(百寿者)は病的老化が少なく、生理的老化も均一に進む傾向があるとされています。
老化を加速させる主な危険因子として「酸化」「糖化」「炎症」が挙げられます。
これらは20世紀後半における老化研究の中で、新たな仮説や科学的知見として注目されてきました。
1956年、米国の医学者デナム・ハーマン博士は、「フリーラジカル説」を提唱しました。
この説では、私たちが呼吸を通じて取り込む酸素の一部が、体内で活性酸素(Reactive Oxygen Species: ROS)に変換されます。
この活性酸素は、細胞や臓器を酸化させ、さらにはDNAに損傷を与えることで全身の老化を引き起こすとされています。

体内の酸素の90%以上は、細胞内小器官であるミトコンドリアでエネルギー(ATP)を生成する過程で消費されます。
このエネルギー生産の副産物としてROSが発生し、ミトコンドリア自体を損傷します。
この損傷によって劣化したミトコンドリアは、さらに多くのROSを生成するという悪循環に陥ります。
こうした背景から、ハーマン博士は後に「ミトコンドリア老化説」を提唱しました。
ただし、フリーラジカル説やミトコンドリア老化説だけでは老化のすべてを説明できません。
最近の研究では、ミトコンドリアには損傷を修復する能力があることが明らかになっています。
また、DNAの損傷だけでは人工的に老化を再現することができないことも示されています。
遺伝子変異が老化の主因ではないことを示す研究として、クローン動物の事例があります。
クローン動物は、成体細胞から取り出した核を未受精卵に移植し、電気刺激などで発生を促進して作られます。

このプロセスでクローン動物は元の体細胞の遺伝情報をそのまま引き継ぎますが、遺伝子変異が老化の原因であるならば、クローン動物は通常よりも短命になるはずです。
しかし実際には、クローン動物の寿命は通常の個体とほぼ同じであることが確認されています。
たとえば、世界初のクローン羊「ドリー」は平均寿命の半分以下で死亡しましたが、その原因は肺疾患であり、老化によるものではありませんでした。
炎症は、体に負荷がかかった際に生じる生理的反応です。
「熱感」「発赤」「腫脹」「痛み」「機能不全」の5兆候が特徴的です。
炎症には急性と慢性の2種類があり、通常は一定期間で治癒します。
しかし、慢性炎症は低レベルで長期間持続し、老化との関連が深いことがわかっています。
限界を超えて分裂できなくなった老化細胞は、加齢とともに体内に蓄積されます。
これらの細胞は単に機能を停止するだけではなく、「老化関連分泌現象(SASP: Senescence-Associated Secretory Phenotype)」と呼ばれる形で、炎症を促進する物質や発ガン促進作用のある物質を分泌することが知られています。
このように、老化細胞の増加は慢性的な炎症状態を引き起こしやすくなります。
この慢性炎症は、さらなる細胞の老化を促進し、やがてそれらの細胞が構成する組織や器官全体の機能低下をもたらします。
結果として、加齢に伴う生理的老化だけでなく、病的老化の進行にもつながると考えられています。
このプロセスの理解が進むにつれ、老化細胞を特異的に除去する「セノリティクス(senolytics)」と呼ばれる新しい治療法が注目されています。
セノリティクスは、老化細胞のみを標的とし、健康寿命の延長や加齢関連疾患の予防に寄与する可能性が期待されています。
人生の浮き沈みがタンパク質とDNAに自然な損傷を与えることに加え、わたしたちは糖とデンプン(いずれも凶悪犯)の過剰摂取という重大な危機の中にいます。
糖とデンプンが血液や組織内に過剰に流れると、それらはタンパク質に付着して、糖化と呼ばれる不可逆的なダメージを引き起こします。
クレーム・ブリュレの表面、揚げた鶏の皮、バゲットの皮のパリパリ感を思い浮かべてください。

これは、アミノ酸が糖に反応して起こる褐変反応、またはメイラード反応と呼ばれ、食べ物を美味しくする反応です。
しかし、これが体内で起こると、この反応はAGE(終末糖化産物)を生成し、RAGE(終末糖化産物受容体)と結合します。
糖がタンパク質と結びつくと、そのタンパク質は機能不全に陥り、病気を引き起こします。
医師が血糖コントロールの評価に用いる検査では、糖が赤血球中のヘモグロビンに結合した結果であるヘモグロビンA1cを測定します。
しかし、この反応は血液中だけで起こるわけではありません。
血管、骨、内臓、筋肉、皮膚、髪の毛など多くの組織や臓器はタンパク質でできています。
そのため、タンパク質の機能を低下させるAGEsの蓄積は体内にさまざまなトラブルを起こします。
例えば、皮膚は表皮、真皮、皮下組織の3層からできていますが、真皮にAGEsが蓄積すると真皮幹細胞の働きが抑制され、新しい線維芽細胞の供給が滞る。
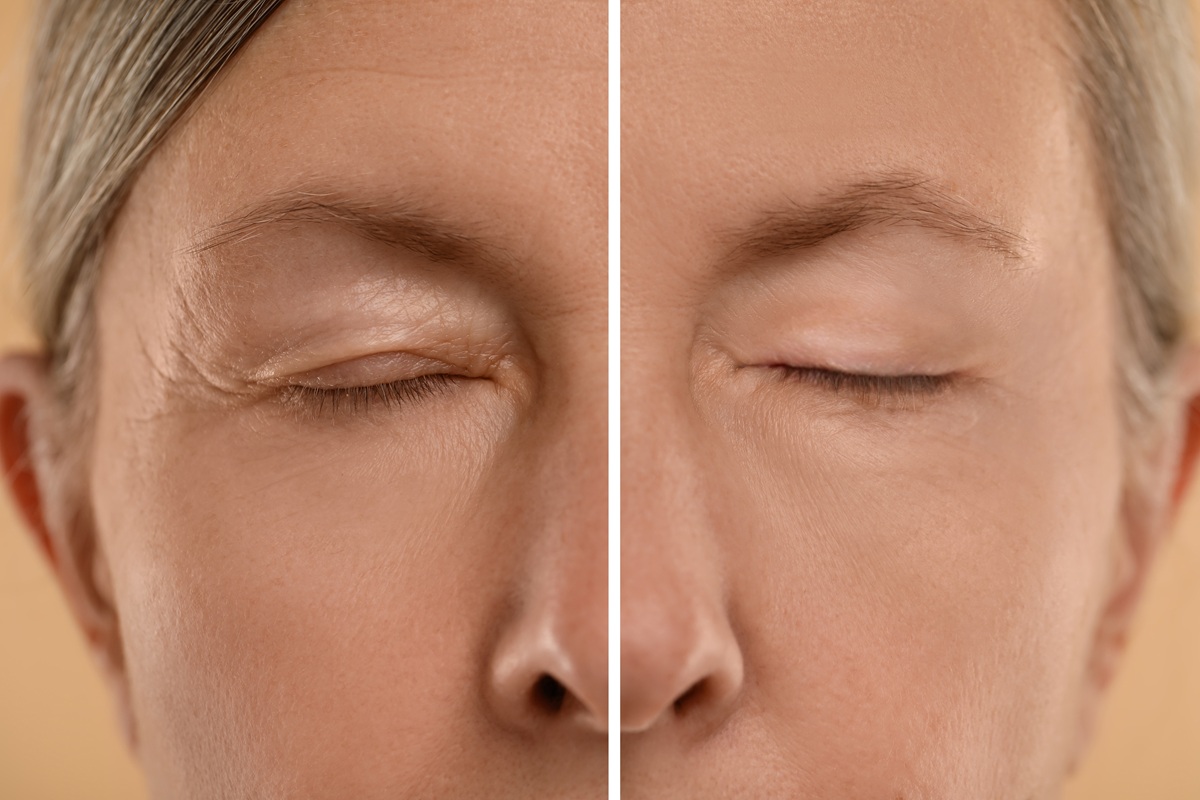
その結果、コラーゲンなどが減少して、皮膚の弾力が失われ、しわやたるみ、くすみに発展します。
骨の体積の半分はコラーゲンでできており、糖化が起きると骨がキャラメル色になり、もろくなります。
目に蓄積すると白内障の一因となり、血管に蓄積すると動脈硬化が進み心筋梗塞や脳梗塞の一因となるのです。
また、血管は硬くなって、高血圧、心不全、腎臓病、認知症(しばしば3型糖尿病と呼ばれる)を引き起こします。
その名前が示す(AGEs)通り、こうした多量の糖とデンプンが、老化の最も強力な原動力であることが明らかになっています。
これらは、長寿スイッチをオフにし、ほぼすべての老化の典型的な特徴を加速させるのです。
つまり、テロメアを短くし、DNA、タンパク質、エピゲノム、ミトコンドリア、マイクロバイオームにダメージを与えます。
さらに、糖とデンプンは炎症を加速させ、ホルモンを攪乱し、幹細胞を老化させます。
前出のマサチューセッツ工科大学(MIT)のレニー・グアランテ博士は、健康で長生きしたいのであれば、糖とデンプンは摂らないか、ごくたまにしか摂らないようにすべきだ、と言及しています。
これまでの研究から、老化は「酸化」「炎症」「糖化」の相互作用を含む複雑で多因子的なプロセスであることがわかっています。
単一の理論では老化の全容を説明できず、さらなる研究が求められています。
天地の法則に背く者は生涯を通して災難に見舞われるが、法則に従うものは危険な病気と無縁でいられる。
黄帝内経(こうていだいけい・中国最古の医学書)

 トップへ戻る
トップへ戻る